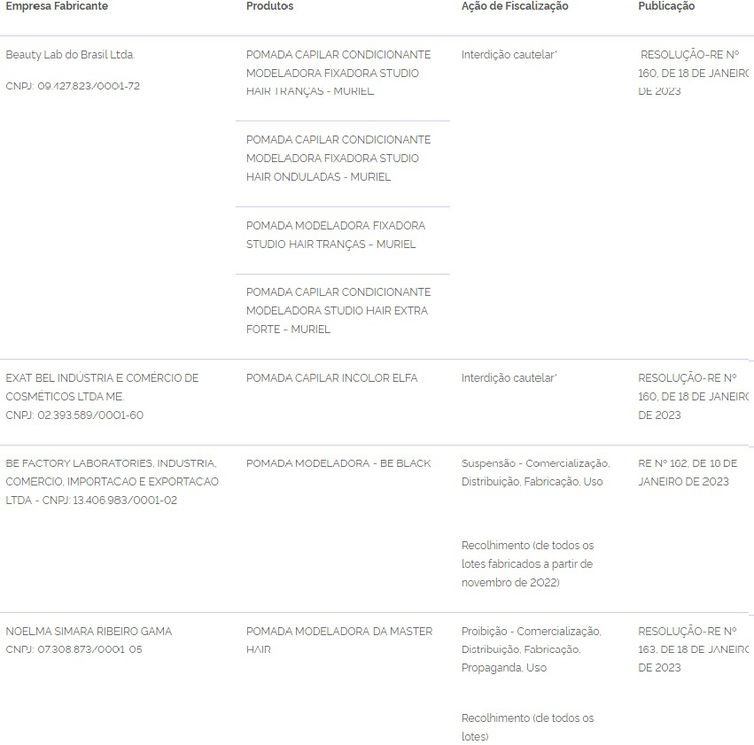
Após relatos de clientes com diversos problemas de saúde, a Agência Nacional de Vigilância Sanitária (Anvisa) anunciou a restrição e o recolhimento de pomadas capilares para modelar tranças. Ao todo, 11 pomadas modeladoras estão com a venda suspensa para que a haja investigação das substâncias contidas nesses produtos e as marcas possam regularizá-las.

Segundo a tricologista e cabeleireira Rosi Ribeiro, os efeitos negativos com o uso das pomadas capilares podem ser sentidos tanto pelo profissional que aplica o produto quanto pelo cliente. Os relatos são de coceira e vermelhidão nos olhos, irritação na pele, inflamação no folículo capilar e até cegueira provisória. Há casos em que o uso reiterado da pomada pode levar ao entupimento do folículo e à queda do cabelo.
##RECOMENDA##
"Houve um caso em que a cliente usou trança durante três meses, o cabelo caiu e o folículo fechou. Em vez de retirar a trança, ela refez o penteado. O maior problema é que, com fechamento desse folículo, o cabelo não nasce mais", contou a profissional.
Informação
A pomada é um cosmético geralmente usado para fixação de penteados. De acordo com a tricologista, substâncias conservantes permitem validade maior do produto, mas podem causar efeitos adversos nos usuários. Esses problemas surgem após contato do produto com água, que faz a pomada escorrer pelo rosto e os olhos. Para Rosi Ribeiro, a melhor forma de prevenção de efeitos negativos é a informação.
"Há um mito de que a mulher precisa sofrer para ficar bonita, mas isso não é verdade. O essencial é ter informação", disse. "Atualmente, cada um pode fazer seu produto. Vai ao laboratório e faz um produto sem controle de quantidade desses conservantes e coloca em excesso. Não é que as substâncias não podem ser usadas, mas que devem seguir regras específicas e com a possibilidade de enxague - o que não acontece atualmente. Assim, as pessoas precisam saber quais são as substâncias que podem provocar riscos à saúde", explicou.
De acordo com a Anvisa, os produtos são alvo de investigação por parte da própria agência reguladora e dos órgãos de Vigilância Sanitária locais devido a relatos de pacientes sobre a ocorrência de eventos adversos graves após o uso. Todos esses produtos podem oferecer risco à saúde.
A Anvisa explica que a interdição das pomadas é uma medida cautelar que visa proteger a saúde da população e que permanece vigente enquanto são realizados testes, provas, análises ou outras providências são requeridas para investigação mais aprofundada do caso.
O que fazer se tiver adquirido o produto
No caso de o consumidor ter um dos produtos em casa, a recomendação é que não o utilize e entre em contato com a empresa para verificar a forma de devolução.
Se o produto já tiver sido usado, em caso de qualquer efeito adverso, o conselho da agência é procurar imediatamente o serviço de saúde e informar a Anvisa pelas páginas de cidadão e profissional que maneja o produto ou de empresas e profissionais da saúde.
De acordo com a tricologista, a instrução é que os clientes procurem produtos com base em substâncias naturais, sem conservantes e por consequência, com validade curta.
"Há uma carência de informação na área de cachos e cabelos afro. Profissionais precisam entender que é possível o serviço ser feito com a mesma qualidade, sem até mesmo o uso da pomada", afirmou. "Muitas pessoas optam por determinadas opções pelo preço, mas a recorrência de produtos muito mais baratos, sem nenhuma regulamentação, a curto prazo. Só que a longo prazo, ou até médio prazo (de 3 a 6 meses), a pessoa pode ter uma calvície permanente", explicou.
Segundo Rosi Ribeiro, os efeitos negativos da pomada podem impactar na autoestima das mulheres. "O uso desses produtos pode levar a uma calvície permanente e isso vai abalar psicologicamente a sua autoestima, sua parte física, além de levar a gastos com diversos profissionais como dermatologistas e psicólogos”, apontou.
Atendimento social
Rosi Ribeiro conduz o projeto social Alisa não, mamãe, uma iniciativa gratuita para ajudar a família a cuidar dos cabelos crespos e cacheados dos pequenos. Voltado para crianças de dois a 14 anos, a proposta é ensinar técnicas para cuidar dos cabelos crespos e cacheados. A profissional avalia o cabelo das crianças e orienta sobre as possibilidades de cuidar do cabelo sem danificá-lo.
Relato
A influenciadora digital Bielle Elizabeth contou em sua conta no Instagram a experiência com uma pomada capilar e o susto ao ficar temporariamente sem a visão. A pomada modeladora usada para fixar penteado no cabelo, caiu nos olhos em virtude de uma chuva.
"Usei a pomada para poder finalizar o baby hair, porque é isso que a gente faz. É uma coisa normal, não tem culpado a não ser a marca da pomada que não tem as indicações corretas para deixar circular no mercado", disse. "Usei a pomada e fui para um evento, eu estava fazendo a publicidade, e choveu. Peguei chuva e automaticamente a pomada escorreu e veio nos meus olhos. Na mesma hora, tive reação", acrescentou.
Com fortes dores nos olhos e sem enxergar, Elizabeth foi recuperando a visão gradualmente após ter sido socorrida e medicada em um pronto-socorro.
"Quem aqui já não deixou um pingo de shampoo cair no olho ao lavar o cabelo no banho? É a regra ficar cego por isso? Não. O mesmo pensamento deve ser aplicado para a pasta modeladora. É de uma extrema irresponsabilidade e covardia culpar as vítimas. Choveu, suou. Algo natural, que em nenhum momento deve ser colocado em xeque para justificar um produto que cause dor ao cliente", disse. "Uma irritação é aceitável até e na exceção. Mas o que estamos vendo aqui é a regra de apenas um dia 140 pessoas tendo reações a um produto que tem em sua química o poder de cegar uma pessoa", completou.